36. 熱エネルギーの容器---比熱と熱容量
[授業のねらい]
バケツに水を入れると水位が上がり,コンデンサーに「電気を入れる」と電位が上がるように,物質に「熱を入れる」と温度(温位)が上ります。
バケツに容量があるように,コンデンサーに容量があるように,物質には熱の容量(キャパシティー)があります。それは物質の何に関係するのか,そして分子論ではどのようなことになるのかを学習します。
[授業の展開]
まず,はじめに§33の復習をしておきましょう。
学校には水熱量計と比熱測定用金属が用意されていて,教科書にも比熱測定実験が載っているので,それを参考にして実験をするのもよいでしょう。このような実験は,周囲と熱エネルギーの出入りがないような「熱の閉鎖系」でおこなうことで,熱量が保存される(正しくは,内部エネルキーが保存される)ことが前提になっています。そのために注意することは,熱量計を濡らさないこと,気温に近い温度で実験することです。熱量計の水をよく撹伴すること,水当量の考えを理解することなども大切です。
金属の比熱をあげておきます。 単位はca1/g℃
(表p164) 1 ca1 は水1gの温度を1℃上げるのに必要な熱量です。これが1 ca1 の定義です。細かいことをいわなければ重ね合わせの原理が成立して,mgの水をt℃上げるのにはmt
ca1 の熱量が必要です。
物質1gの温度を1℃ 上げるのに必要な熱量をその物質の比熱といいます。
したがって,比熱がc ca1/g℃ の物質 mg の温度をt℃ 上げるのに必要な熱量をQ ca1 とすると Q=mct
cal=g・cal/g℃・℃
はじめの水の場合には,その比熱が1 ca1/g℃ だったのです。そうしないと,単位があいません。物理て使う温度目盛りは摂氏温度℃でなく,絶対温度K(ケルビン)のほうが合理的なのて,以後,℃てなくてKを使います。℃とKは温度目盛りの間隔が同じです。mcは,その物体の熱のキャパシティーを示す量で,これを熱容量といいCcal/Kて表します。したがって,Q=Ct
≪問1≫ 熱容量の大きなものは周囲の温度の影響を受けにくいことになります。逆にいえは,周囲のものに対して,その温度の影響を大きく与えることができます。要するに,物体がその温度になるまでの熱の供給源(正負とも)になれるということです。そのようなものを熱源といいます。熱源になれるものの具体的な例をあげてみましょう。
大気は熱機関の低熱源として使われます。水は熱容量が大きいので,これも低熱源として,つまり冷却水として使います。いわゆる空冷,水冷というヤツです。大洋や大陸も大熱源です。地熱発電では地球が熱源です。太陽は高熱源,宇宙空間(に存在する物質群)は低熱源でしょうね。風呂も一種の熱源で,人体も定温の熱源になります。
温度が分子の運動エネルギーにかかわるということがわかったので(§35),比熱も同じ数の分子からなる量で比較することが合理的であることがわかります。したがって,単位量として1gでなくて1mo1をとることにします。物質1mo1の温度を1K上げるのに必要な熱エネルギーをモル比熱といいます。単位はJ/molK,あるいはca1/mo1Kてす。
≪問2≫ ヘリウムガスのモル比熱を求めなさい。
気体の内部エネルギーをUとすると,理想的気体の場合には,その実体は分子の運動エネルギーの総和なので,U=1/2mv2×N0×n=3/2nRT(nはmo1数,R=8.31
J/mol K=2 .00 ca1/mo1 K)1mo1について考えると,その変化量は △U=3/2×1×2.00×△T=3. 00△T (1) また,内部エネルギーの増加は,外から熱量Qの形と,仕事Wの形で与えられたエネルギーて決まるので △U=Q十W
(2) ここでは仕事Wには無関係な<定積変化>を考えると W=p△V=p×0=0
モル比熱は △U=Q=3.00×1=3.00(cal/mo1K)
単原子分子のモル比熱は3カロリーです。ネオン,アルゴン,クリプトン,キセノンなと単原子分子気体はみんな3カロリーです。
物体の運動には,併進運動と回転運動かあります。分子の運動についても同じてす。しかし,単原子分子は回転していても他の分子と相互作用をしないので(「摩擦」がないので,回転運動の交換ができない),エネルギーのやりとりがありません。
≪問3≫
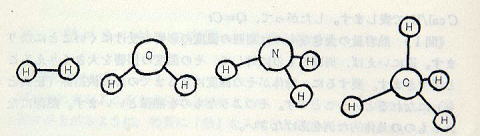
図のモデルで示されたH2分子の回転のモード(方式)をいいなさい。
水素原子を結ぶ「結合手」の方向(x軸としておく)を軸とする回転は相互作用をしない(4行上)ので,これに垂直な2方向(y軸,z軸とする)を軸とした回転だけが「生きて」います。以後の問題も同様てすが,発泡スチロール球をつないて分子模型をつくり(化学室にあるかもしれない),運動のパターンを確認しましょう。
(図p166)
≪問4≫
2原子分子のモル比熱はいくらてすか。
2原子分子の自由度は5で,エネルギーは5つに等配分されます。
1/2mvx2+1/2mvy2+1/2mvz2+1/2Iωy2+1/2Iωz2=5/2mvx2lmo1について考えれは 5/2mvx2=5/2RT
したがって,2原子分子のモル比熱は5 cal/mo1Kとなります。
液化しやすい分子では,ポテンシャルエネルギーが問題になるので,温度が低くない希薄な気体で考えると,H2, O2, N2, HCl, CO,
NOなどのモル比熱はみんな5 ca1 てす。
≪問5≫ 3原子分子のモル比熱はいくらてすか。
3原子分子では,併進3,回転3の6自由度をもつのて,モル比熱は6ca1になるはずです。 二酸化炭素CO2は分子の形が直線的なのて,自由度は5になるはずです。(もしそうならない場合には,別な理由があるはずです)。このことは,逆に,モル比熱を測ってみると,分子の形が想定できようというものてす。
上の問題では,気体の体積を一定にして考えました。つまり,加えた熱の全部が内部エネルギーに転化されるという場合です。
つぎには,気体を入れた容器のピストンが移動して,圧力が一定になるような状態で考えます。外から加えた熱は,一部は内部エネルギーの増加に使われますが,一部はピストンの動きで仕事になって失われます。
△U=Q+W=Q-p△V Q=△U+p△V
RT=pV R△T=△(pV)=△pV+p△V=p△V
(∵△p=0)
1mo1の単原子分子では △U=3/2R△T
Q=3/2R△T+R△T=5/2R△T
これでも比熱が考えられて Q/△T=5.0 ca1/mo1K で,これを定圧モル比熱といいます。これに対して定積の場合は,定積モル比熱といいます。このような形てガスの温度を1Kアップさせるのには,5ca1の熱が必要ですが,そのうちの2ca1は外へ仕事となって逃けていってしまい,残りの3ca1がガスの温度上昇に使われます。
≪問6≫
モル比熱の表をつくりなさい。 (表p167-1)
≪問7≫
定積モル比熱Cvと定圧モル比熱Cpの比Cp/Cvを比熱比といいます。
単原子分子およひ2原子分子の比熱比はいくらてすか。
単原子分子の比熱比は 5/3=1.67
2原子分子の比熱比は
7/5=1.40
多原子分子の比熱比は 8/6=1.33
比熱比の測定については,音速の項(§46)で述べます。
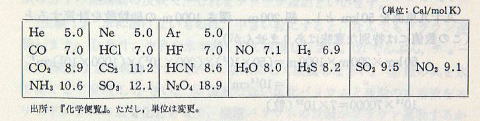
つぎに,気体分子の25℃における定圧モル比熱をあげておきます。(表p167-2)
≪問8≫
この表を見て,感想をいいなさい。
分子が複雑になると,併進と回転のほかに,振動のように,別の運動の自由度も関係してきて,それにもエネルギーが与えられるように見えます。
これまでに習ってきたニュートン力学がミクロの世界にも適用できることがわかったことは大切なことです。
金属のモル比熱では,定積モル比熱が考えられます。その値を下の表に示しておきます。単位はca1/mo1Kてす。これを,原子熱といいます。金属の原子熱は約6
ca1 です。以前は,原子量,分子量にgの単位をつけた量をグラム原子,グラム分子といい,とくに1g分子を1mo1と呼んでいましたが,現在では1g原子のことも1mo1と呼びます。 (表p168)
molの定義は「モルは0.012kgの炭素12の中に存在する原子と等しい数の要素粒子を含む系のある物質量である」となっています。<0.012
kg の炭素12の中に存在する原子と等しい数>というのはモル分子数N0のことですから,N0個の分子を1mo1分子,N0個の原子を1mol原子,N0個の電子を1
mol 電子,N0個のイオンを1molイオン,N0個の砂を1mo1の砂,と使ってもよいのです。 1 mol の…というのは,N0個の…ということですから,1mo1というのはN0個ということです。つまり,mo1というのは数の単位と考えてもよさそうです。
九十九里浜の砂を数えてみました。
グラフ用紙の縦横10cmを区切り,その1cm2の枠に1から100までのナンバーをふって,その上に小匙1杯の砂を平均して撒きました。それぞれの枠の中の砂粒の数をルーペて数えたのち,全部を加えると11261粒あり,この質量を測ると0.275
g ありました。これから1gの砂粒の量は41000粒となります。砂の密度は1.7g/cm3なので,1cm3の砂粒の数は約70000粒です。ここでいう<砂>とは,空隙をも含めた状態名のことです。
九十九里浜を50kmとし,幅200 m,深さ1000mの砂粒数を計算すると(この数値には特別な意味はありませんが),50km×200m×1000m=(50×105)×(200×102)×(1000×102)cm3=1016
cm3 1016×70000=7×1020(粒)
1molは6×1023個だから,この数は約1mmol
(ミリモル)です。
つぎに,米粒をカウントしてみました。一つかみの米を紙の上に広げて,楊枝の先で一度に5粒ずつ数えていき,2000粒を分けとりました。 2000粒で38.877gでした。1kgで51500粒です。
世界の米の産額を300,000,000,000 kg とすると,その数は1.5×1016個,こんな調子で4000年作り続けても,米粒はやっと,約1mmol
です。
≪問9≫
結晶である金属には,どのような自由度が考えられますか。
固体は体積が一定なので,比熱は定積のものを考えます。原子は結晶状態で固定されているので,運動は振動だけと考えられます。3方向の振動のそれぞれに位置と速度の自由度,つまり2自由度があって,全体の6自由度のそれぞれに1
ca1 ずつのエネルギーが配給されているようです。
この辺のことについて,2,3のコメントをしておきます。
(1)金属状態の原子の結合では,原子間の振動の自由度にエネルギーが配分されているのに,気体分子の原子間の振動にはエネルギーが配分されないのには事情がありそうです。原子間の結合が弱くなると,わずかに配分されるようになります。
(2)金属の原子熱でも,低温になるとエネルギーの配給(?)が悪くなります。
(3)1自由度に配分されるエネルギーが1 ca1 ずつという数値の単純さは,まったく<偶然の幸運>というものてす。
≪問10≫ 先にあげた金属の比熱(単位ca1/g K)と,ここにあげた金属の比熱(単位 ca1/mo1K)との関係をいいなさい。
例えばA1の場合には 0.22ca1/g K(表p164)
および 5.7ca1/mo1K(表p168)。
AIの原子量は27なので 5.7cal/mo1K÷27g/mo1=0.21cal/g Kモル比熱を原子量で割れは通常の比熱になります。
これまで,気体と固体の熱運動について考えてきましたが,液体についても同じことがいえます。
花粉のでんぷん粒が水の中(表面)で見せる不規則な運動は水の分子の熱運動の反映で,これをブラウン運動といいます。
≪実験1≫ 水に溶けないものは,小さい粒にすると,なんでもブラウン運動します。①墨汁,牛乳を水て薄くして検鏡しなさい。②でんぷん,チョーク,硫黄などを乳鉢でていねいに粉末にして、水に浮かせて検鏡しなさい。
③絵の具を水で薄くして検鏡しなさい。④濃度の低い塩化バリウムと硫酸の水溶液をスライドグラスの上で化合させて,硫酸バリウムの沈殿がブラウン運動するかどうか確かめてみましょう。そのほか,なにを検鏡したいと思いますか?
[まとめ]
1 比熱や熱容量で自然が見られるようになります。
2 比熱はmo1を単位にするのが合理的です。
3 気体の比熱には定積比熱と定圧比熱があります。
4 1mo1の気体では1自由度に1
ca1
の熱エネルギーが割り当てられます。
5 単原子分子の比熱比は1.67,2原子分子のそれは1.40です。
6 水に溶けないものを小さい粒にすると,なんでもブラウン運動します。